Пептиды представляют собой класс соединений, образованных в связи с соединением множественных аминокислот через пептидные связи. Они вездесущи в живых организмах. До сих пор в живых организмах были обнаружены десятки тысяч пептидов. Пептиды играют важную роль в регулировании функциональной активности различных систем, органов, тканей и клеток и в жизненной активности, и часто используются в функциональном анализе, исследовании антител, разработке лекарств и других областях. С разработкой биотехнологии и технологии синтеза пептидов все больше и больше пептидных препаратов были разработаны и применяются в клинике.
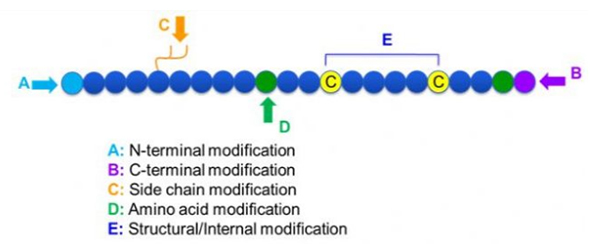
Существует широкий спектр модификаций пептидов, которые можно просто разделить на модификацию после модификации и процесса (с использованием производной аминокислотной модификации), а также N-концевую модификацию, C-концевую модификацию, модификацию боковой цепи, модификация аминокислот, модификация скелета и т. Д. В зависимости от сайта модификации (рисунок 1). В качестве важного средства для изменения основной цепной структуры или групп боковой цепи пептидных цепей, модификация пептидов может эффективно изменить физические и химические свойства пептидных соединений, увеличить растворимость воды, продлить время действия in vivo, изменять их биологическое распределение, устранение иммуногенности, снижение токсичных эффектов и т. Д. В этой статье, несколько основных стратегии модификации пептидов, и их характеристики.
1. Циклизация
Циклические пептиды имеют много применений в биомедицине, и многие природные пептиды с биологической активностью являются циклическими пептидами. Поскольку циклические пептиды имеют тенденцию быть более жесткими, чем линейные пептиды, они чрезвычайно устойчивы к пищеварительной системе, могут выжить в пищеварительном тракте и демонстрировать более сильную аффинность к рецепторам -мишеням. Циклизация является наиболее прямым способом синтеза циклических пептидов, особенно для пептидов с большим структурным скелетом. Согласно режиму циклизации, его можно разделить на тип цепи боковой цепи, тип терминала - боковой цепи, тип терминала - тип терминала (тип конца к конечному типу).
(1) боковая кость до сидея
Наиболее распространенным типом циклизации боковой цепь к боковой цепь является дисульфидная мостика между остатками цистеина. Эта циклизация вводится парой остатков цистеина, которые дезализируются, а затем окисляют с образованием дисульфидных связей. Полициклический синтез может быть достигнут путем селективного удаления групп защиты сульфгидрила. Циклизация может быть выполнена либо в растворителе после рассеяния, либо на предварительной смоле. Циклизация на смолах может быть менее эффективной, чем циклизация растворителей, потому что пептиды на смолах не легко образуют циклифицированные конформации. Другим типом циклизации боковой цепи является образованием амидной структуры между аспартациновой кислотой или остатками глутаминовой кислоты и основой аминокислоты, которая требует, чтобы группа защиты боковой цепи была способной быть избирательно удаленной из полипептида либо на смоле, либо после диссоциации. Третий тип боковой цепи-боковой цепной циклизации-это образование дифениловых эфиров с помощью тирозина или p-гидроксифенилглицина. Этот тип циклизации в натуральных продуктах обнаруживается только в микробных продуктах, а продукты циклизации часто имеют потенциальную лекарственную ценность. Подготовка этих соединений требует уникальных условий реакции, поэтому они не часто используются в синтезе обычных пептидов.

(2) терминал до сидея
Циклизация цепи терминала обычно включает С-концевой с аминогруппой боковой цепи лизина или орнитина или N-концевой с боковой цепью аспарагиновой кислоты или глутаминовой кислоты. Другая полипептидная циклизация производится путем образования эфирных связей между терминалами C и сериновыми или треонинами.
(3) Тип терминала или головы на хвост
Цепные полипептиды могут быть либо циклированы в растворителе, либо фиксированы на смоле с помощью боковой цепной велосипеды. Низкие концентрации пептидов должны использоваться в централизации растворителя, чтобы избежать олигомеризации пептидов. Выход полипептида синтетического кольца с головой на хвост зависит от последовательности цепного полипептида. Следовательно, перед тем, как подготовка циклических пептидов в больших масштабах, должна сначала быть создана библиотека возможных цепных свинцовых пептидов, а затем циклизация, чтобы найти последовательность с наилучшими результатами.
2. N-метилирование
N-метилирование первоначально происходит в природных пептидах и вводится в пептид-синтез, чтобы предотвратить образование водородных связей, что делает пептиды более устойчивыми к биодеградации и клиренсу. Синтез пептидов с использованием N-метилированных аминокислотных производных является наиболее важным методом. Кроме того, реакция Mitsunobu на септид-полипептид-резиновых промежуточных соединениях (2-нитробензол сульфонилхлорид) с метанолом также может использоваться. Этот метод использовался для приготовления циклических пептидных библиотек, содержащих N-метилированные аминокислоты.
3. Фосфорилирование
Фосфорилирование является одной из наиболее распространенных посттрансляционных модификаций в природе. В клетках человека более 30% белков фосфорилируются. Фосфорилирование, особенно обратимое фосфорилирование, играет важную роль в контроле многих клеточных процессов, таких как трансдукция сигнала, экспрессия генов, клеточный цикл и регуляция цитоскелета и апоптоз.
Фосфорилирование можно наблюдать в различных аминокислотных остатках, но наиболее распространенными целевыми показателями фосфорилирования являются остатки серина, треонина и тирозина. Производные фосфотирозина, фосфотреонина и фосфосерина могут либо вводить в пептиды во время синтеза, либо образуются после синтеза пептидов. Селективное фосфорилирование может быть достигнуто с использованием остатков серина, треонина и тирозина, которые избирательно удаляют защитные группы. Некоторые реагенты фосфорилирования также могут вводить группы фосфорной кислоты в полипептид путем пост -модификации. В последние годы сайт-специфическое фосфорилирование лизина было достигнуто с использованием химически селективной реакции Staudinger-фосфита (рис. 3).

4. Миристоилирование и пальмитоилирование
Ацилирование N-концевого с жирными кислотами позволяет пептидам или белкам связываться с клеточными мембранами. Миридамоилированная последовательность на N-конце позволяет протеинкиназам семейства SRC и белкам GAQ обратной транскриптазы для связывания с клеточными мембранами. Миристическая кислота была связана с N-концевым полипептидом смолы с использованием стандартных реакций связи, и результирующий липопептид может быть диссоциирован в стандартных условиях и очищен с помощью RP-HPLC.
5. Гликозилирование
Гликопептиды, такие как ванкомицин и тиколанин, являются важными антибиотиками для лечения лекарственных бактериальных инфекций, а другие гликопептиды часто используются для стимуляции иммунной системы. Кроме того, поскольку многие микробные антигены гликозилированы, значит для изучения гликопептидов для улучшения терапевтического эффекта инфекции. С другой стороны, было обнаружено, что белки на клеточной мембране опухолевых клеток демонстрируют аномальное гликозилирование, что заставляет гликопептиды играют важную роль в исследованиях рака и иммунной защиты опухоли. Гликопептиды получают методом FMOC/T-BU. Гликозилированные остатки, такие как треонин и серин, часто вводятся в полипептиды с помощью FMOC, активированных пентафторофенолом, для защиты гликозилированных аминокислот.
6. изопрен
Изопентадиенилирование происходит на остатках цистеина в боковой цепи вблизи С-терминала. Изопрен белка может улучшить аффинность клеточной мембраны и образовывать взаимодействие белка белка. Изопентадированные белки включают тирозинфосфатазу, небольшую GTASE, молекулы кокиперона, ядерную пластинку и центромерные связывающие белки. Изопрено -полипептиды могут быть получены с использованием изопрена на смолах или путем введения производных цистеина.
7. Модификация полиэтиленгликоля (PEG)
Модификация ПЭГ может быть использована для улучшения гидролитической стабильности белка, биораствования и растворимости пептидов. Введение цепей ПЭГ в пептиды может улучшить их фармакологические свойства, а также ингибировать гидролиз пептидов протеолитическими ферментами. Пептиды ПЭГ проходят через клубочковое поперечное сечение капилляров легче, чем обычные пептиды, значительно снижая почечный клиренс. Из-за расширенного активного периода полураспада ПЭГ-пептидов in vivo, нормальный уровень лечения можно поддерживать с помощью более низких доз и менее частых пептидных лекарств. Тем не менее, модификация ПЭГ также имеет негативные последствия. Большие количества ПЭГ предотвращают разложение фермента, а также уменьшают связывание пептида с рецептором -мишенем. Но низкая аффинность ПЭГ-пептидов обычно компенсируется их более длинным фармакокинетическим полураспадом, и, будучи дольше присутствующего в организме, ПЭГ-пептиды имеют большую вероятность поглощения в ткани-мишени. Следовательно, спецификации полимера ПЭГ должны быть оптимизированы для оптимальных результатов. С другой стороны, пептиды PEG накапливаются в печени из -за снижения почечного клиренса, что приводит к макромолекулярному синдрому. Следовательно, модификации ПЭГ должны быть разработаны более тщательно, когда пептиды используются для тестирования лекарств.

Common modification groups of PEG modifiers can be roughly summarized as follows: Amino (-amine) -NH2, aminomethyl-Ch2-NH2, hydroxy-OH, carboxy-Cooh, sulfhydryl (-Thiol) -SH, Maleimide -MAL, succinimide carbonate -SC, succinimide acetate -SCM, succinimide propionate -SPA, N-гидроксисукцинимид -NHS, акрилат-CH2CH2COOH, альдегид -чо (такие как пропиональный, бутиральд), акриловое основание (-акрилат-АКРЛ), азидо-азозид, биотиниль-биотин, флуоресцеин, глютарил -га, ацерилат-гидрозовый, алькин-хероановый, алькин-хелин, флуоресцеина, глютарил -га, ацидо-гидрозовый P -TolueneSulfonate -OT, сукцинимид сукцината -SS и т. Д. Производные ПЭГ с карбоновыми кислотами могут быть связаны с N -концевыми аминами или боковыми цепями лизина. Амино-активированный ПЭГ может быть связан с аспарагиновой кислотой или глютаминовой кислотой. MAL-активированный ПЭГ может быть конъюгирован с Меркаптаном полностью дезажившихся цепей боковых цепей цистеина [11]. Модификаторы PEG обычно классифицируются следующим образом (Примечание: MPEG-метокси-PEG, CH3- (CH2CH2O) N-C2CH2-OH):
(1) Модификатор ПАГ Прямой цепи
MPEG-SC, MPEG-SCM, MPEG-SPA, MPEG-OTS, MPEG-SH, MPEG-ALD, MPEG-BUTYRALD, MPEG-SS
(2) Бифункциональный модификатор ПЭГ
HCOO-PEG-COOH, NH2-PEG-NH2, OH-PEG-COOH, OH-PEG-NH2, HCL · NH2-PEG-COOH, MAL-PEG-NHS
(3) Модификатор ветвящегося ПЭГ
(MPEG) 2-NHS, (MPEG) 2-ALD, (MPEG) 2-NH2, (MPEG) 2-MAL
8. Биотинизация
Биотин может быть сильно связан с авидином или стрептавидином, а прочность связывания даже близка к ковалентной связи. Биотиновые пептиды обычно используются в иммуноанализ, гистоцитохимии и флуоресцентной проточной цитометрии. Меченые антитела к антибиотину также могут быть использованы для связывания биотинилированных пептидов. Метки биотина часто прикрепляются к боковой цепи лизина или к терминалу N. 6-аминокапроновая кислота часто используется в качестве связи между пептидами и биотином. Связь гибкая при связывании с субстратом и лучше связывается в присутствии стерического препятствия.
9. Флуоресцентная маркировка
Флуоресцентная маркировка может быть использована для отслеживания полипептидов в живых клетках и для изучения ферментов и механизмов действия. Триптофан (TRP) флуоресцентный, поэтому его можно использовать для внутренней маркировки. Спектр излучения триптофана зависит от периферической среды и уменьшается с уменьшением полярности растворителя, свойства, которое полезно для обнаружения структуры пептидов и связывания рецептора. Флуоресценция триптофана может быть погашена протонированной аспарагиновой кислотой и глутаминовой кислотой, что может ограничить его использование. Группа дансилового хлорида (дансил) очень флуоресцентная при аминогруппе и часто используется в качестве флуоресцентной метки для аминокислот или белков.
Флуоресцентное резонансное преобразование энергии (FRET) полезно для исследований ферментов. Когда применяется FRET, полипептид субстрата обычно содержит группу флуоресцентной маркировки и группу флуоресценции. Меточные флуоресцентные группы гасили гаситель с помощью нефотонной переноса энергии. Когда пептид диссоциируется от рассматриваемого фермента, группа маркировки излучает флуоресценцию.
10. Клетные полипептиды
Клетные пептиды имеют оптически съемные защитные группы, которые защищают пептид от связывания с рецептором. При воздействии ультрафиолетового излучения пептид активируется, восстанавливая его сродство к рецептору. Поскольку эта оптическая активация может контролироваться в соответствии с временем, амплитудой или местоположением, пептиды клеток могут использоваться для изучения реакций, возникающих в клетках. Наиболее часто используемыми защитными группами для полипептидов клетки являются 2-нитробензильные группы и их производные, которые могут быть введены в синтез пептидов посредством защитных аминокислотных производных. Производные аминокислоты, которые были разработаны, - это лизин, цистеин, серин и тирозин. Производные аспартата и глутамата, однако, обычно не используются из -за их восприимчивости к циклизации во время синтеза пептидов и диссоциации.
11. Полиантигенный пептид (карта)
Короткие пептиды обычно не являются невосприимчивыми и должны быть связаны с белками -носителями для получения антител. Полиантигенный пептид (MAP) состоит из множества идентичных пептидов, связанных с ядрами лизина, которые могут специфически экспрессировать иммуногены высокой активности и могут использоваться для приготовления белковых куплетов пептид-карьера. Полипептиды карты могут быть синтезированы синтезом твердой фазы на карте смолы. Тем не менее, неполная связь приводит к отсутствующим или усеченным пептидным цепям на некоторых ветвях и, следовательно, не демонстрирует свойства исходного полипептида карты. В качестве альтернативы, пептиды могут быть получены и очищены отдельно, а затем связаны с картой. Пептидная последовательность, прикрепленная к пептидному ядру, хорошо определена и легко характеризуется масс-спектрометрией.
Заключение
Модификация пептидов является важным средством проектирования пептидов. Химически модифицированные пептиды могут не только поддерживать высокую биологическую активность, но и эффективно избегать недостатков иммуногенности и токсичности. В то же время химическая модификация может надевать пептиды некоторыми новыми превосходными свойствами. В последние годы был быстро развит метод активации C-H для постмодификации полипептидов, и было достигнуто много важных результатов.
Время публикации: 2025-07-03
