Резонансный перенос энергии флуоресценции (FRET)
Резонансный перенос энергии флуоресценции (FRET) представляет собой процесс безызлучательной передачи энергии, при котором энергия возбужденного состояния донора передается в возбужденное состояние акцептора посредством взаимодействия межмолекулярных электрических пар.В этом процессе не участвуют фотоны, поэтому он является безызлучательным.Преимущество этого анализа состоит в том, что он быстрый, чувствительный и простой.
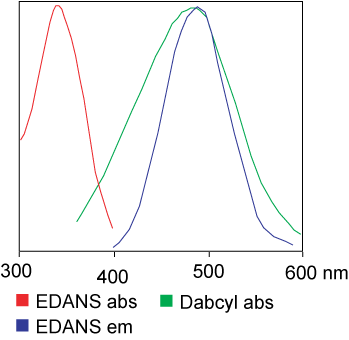
Краситель, используемый в анализе FRET, может быть идентичным.Но в большинстве случаев на самом деле используются разные красители.Вкратце, передача световой резонансной энергии — это передача пары диполей от донора (краситель 1) к акцептору (краситель 2) при возбуждении донорной группы.В целом спектр излучения донорной группы флуорофора перекрывается со спектром поглощения акцепторной группы.«Когда расстояние между двумя флуорофорами подходящее (10–100 А), можно наблюдать передачу энергии флуорофора от донора к акцептору».Способ передачи энергии зависит от химического строения рецептора:
1. Преобразуется в молекулярную вибрацию, то есть световой свет передачи энергии исчезает.(Рецептор является гасителем света)
2. Излучение более интенсивное, чем сам рецептор, что приводит к красному смещению вторичного спектра флуоресценции».(Рецепторы являются излучателями света).
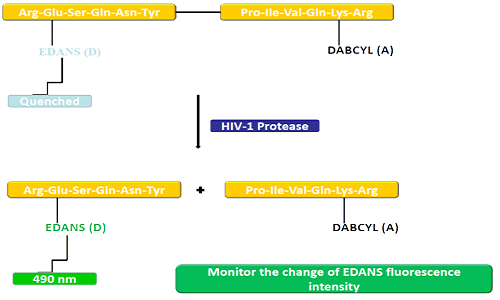
Группа доноров (EDANS) и ген-акцептор (DABCYL) равномерно связаны с природным субстратом протеазы ВИЧ, и когда субстрат не отсоединен, DABCYL может подавлять EDANS и затем становиться необнаружимым для фтора.После отключения протеазы ВИЧ-1 EDANS больше не подавляется DABCYL, и впоследствии можно обнаружить люциферазы EDANS.Наличие ингибиторов протеаз можно контролировать по изменению интенсивности флуоресценции ЭДАНС.
Пептиды FRET являются удобными инструментами для изучения неспецифичности пептидаз.Поскольку процесс реакции можно постоянно контролировать, он представляет собой удобный метод определения активности фермента.Блеск, возникающий после гидролиза пептидных связей донором/акцептором, является мерой активности фермента при наномолярных концентрациях.Когда пептид FRET не поврежден, происходит внезапное исчезновение внутренней вспышки, но когда разрывается любая пептидная связь напротив донора/акцептора, возникает вспышка, которую можно постоянно обнаруживать, а затем можно количественно оценить активность фермента.
Время публикации: 14 августа 2023 г.