По способу соединения аминокислоты и сахара сахарный пептид можно разделить на четыре категории: O-гликозилирование, C a N-гликозилирование, осахаривание росы и соединение GPI (гликофосфатидлиинозитол).
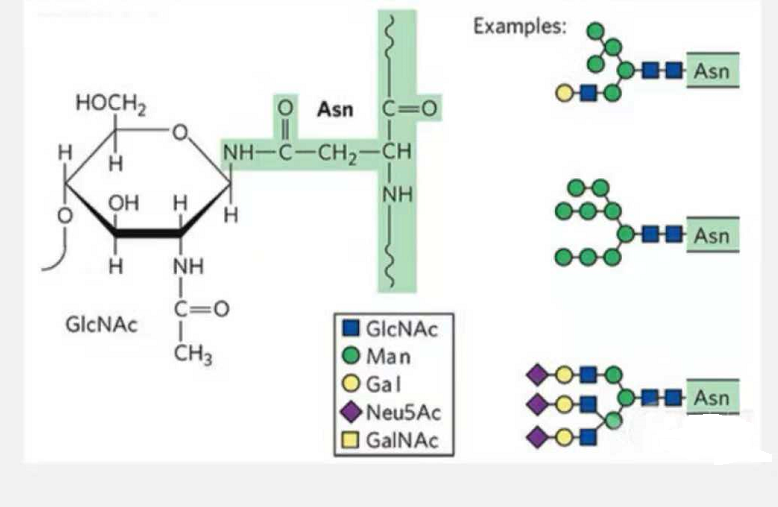
1. Гликопептиды N-гликозилирования состоят из N-ацетамидной глюкозы на восстанавливающем конце гликановой цепи (Glc-Nac), связанной с атомом N амидной группы боковой цепи некоторых Asn в пептидной цепи, и Asn способный связать гликановую цепь, должен располагаться в составе AsN-X-Ser/Thr (X!=P) в мотиве, образованном остатками.Сахар – N-ацетилглюкозамин.
Структурный гликопептид, модифицированный N-гликозилированием
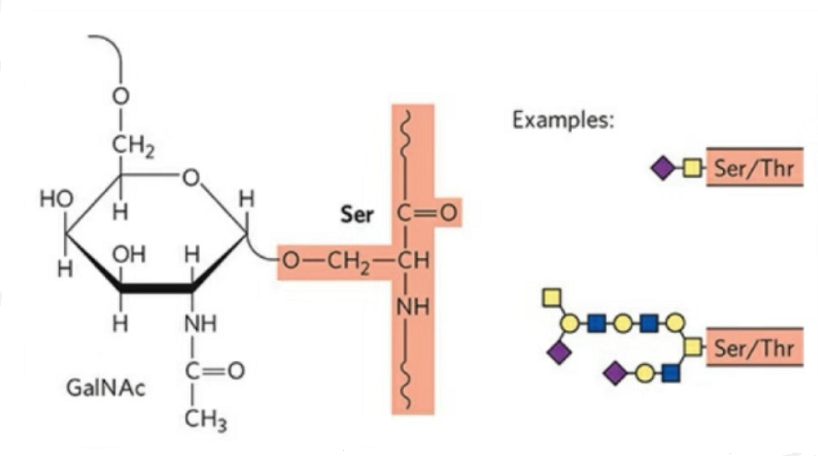
2. Структура О-гликозилирования проще, чем N-гликозилирования.Этот гликопептид обычно короче гликана, но имеет больше типов, чем N-гликозилирование.Ser и Thr обычно могут быть гликозилированы в пептидной цепи.Кроме того, существуют гликопептиды, декорированные гликозилированием тирозина, гидроксила и гидроксипролина.Положением связи является гидроксильный атом кислорода в боковой цепи остатка.Связанными сахарами являются галактоза или N-ацетилгалактозамин (Gal&GalNAc) или глюкоза/глюкозамин (Glc/GlcNAc), манноза/маннозамин (Man/ManNAc) и т. д.
О-гликозилирование изменяет структуру
3. Гликопептид O-GlcNAC гликозилирование ((N-ацетилцистеин (NAC)) (glcnAcN-ацетилглюкозамин/ацетилглюкозамин)
Одиночное гликозилирование N-ацетилглюкозамина (GlcNAc) соединяет белки O-GlcNAc с гидроксильным атомом кислорода остатка серина или треонина белка.Гликозилирование O-GlcNA представляет собой моносахаридный орнамент O-GlcNAc без гликанового удлинения;Подобно фосфорилированию пептидов, гликозилирование гликопептидов O-GlcNAc также представляет собой динамический процесс декорирования белка.Аномальное украшение O-GlcNAc может вызывать различные заболевания, такие как диабет, сердечно-сосудистые заболевания, опухоли, болезнь Альцгеймера и так далее.
Точки гликозилирования гликопептидов
Основные структуры полипептидов и сахарных цепей связаны с белковыми цепями ковалентными связями, а участки, связывающие сахарные цепи, называются сайтами гликозилирования.Поскольку не существует шаблона, по которому можно было бы отслеживать биосинтез гликопептидных сахарных цепей, разные сахарные цепи будут присоединяться к одному и тому же участку гликозилирования, что приводит к так называемой микроскопической неоднородности.
Гликозилирование гликопептидов
1. Влияние гликозилирования гликопептидов на эффективность терапии терапевтическими белками.
В случае терапевтически-терапевтических белков гликозилирование также влияет на период полувыведения и нацеливание белковых препаратов in vivo.
2. Гликозилирование растворимых гликопептидов и белки.
Исследования показали, что сахарные цепи на поверхности белков могут улучшить молекулярную растворимость белков.
3. Гликопептидное гликозилирование и иммуногенность белков.
С одной стороны, сахарные цепи на поверхности белков могут вызывать специфические иммунные реакции.С другой стороны, сахарные цепи могут покрывать определенные поверхности белка и снижать его иммуногенность.
4. Гликопептидное гликозилирование, повышающее стабильность белка.
Гликозилирование позволяет повысить стабильность белков к различным условиям денатурации (таким как денатуранты, нагревание и т. д.) и избежать агрегации белков.В то же время сахарные цепи на поверхности белков могут также перекрывать некоторые точки протеолитического распада белковых молекул, тем самым повышая устойчивость белков к протеиназам.
5. Гликопептидное гликозилирование, влияющее на биологическую активность белковых молекул.
Изменение гликозилирования белка также может позволить белковым молекулам формировать новую биологическую активность.
Время публикации: 03 августа 2023 г.